Titelseite, Vorwort, Inhaltsverzeichnis
ISSN: 2571-5860IONENCHROMATOGRAPHIEBerzelius-Laborjournal, 2.02, 04/2021 (V01: 11/2020)
Vorwort
Starten tut dieses BLJ mit der Evolution der IC, mit Exkursen zum Ionenaustausch, den Seltenen Erden und zur Atom-spaltung. Dann lernt ihr die wichtigsten Bauteile des Ionen- chromatographen kennen, bevor ihr in Videoanimationen mit der Probe durch das Gerät reist, von der Injektion über die Trennung bis hin zur Detektion. In einem Interview mit einem der erfahrensten IC-Entwickler, Dr. Markus Laeubli von der Metrohm, erfahrt ihr viel Interessantes und Überraschendes rund um diese faszinierende Technik.
Dann seid ihr dran: Ein Video erklärt das Ansetzen des Fliessmittels, des Eluenten und das Inbetriebnehmen des ICs. Dann analysiert ihr die Getränkeproben auf Kationen und biogene Amine. Es folgen einige Worte zur Qualitätskontrolle, Kapitel zur Probenvorbereitung, zu Säulen sowie weiteren Trenn- und Detektionsmechanismen. Zuletzt findet ihr noch einige Anregungen für den Unterricht. Viel Spass.
Inhaltsverzeichnis
HAUPTKAPITEL ⇓ & EXKURSE ⇒
Evolution der Ionenchromatographie
Moses und der IonenaustauschCa. 1280 vor ChristusIrgendwo in der Wüste zwischen Ägypten und Israel

Geburtsstunde der Chromatographie März 1903Auf einer Tagung in Warschau, Polen
Tswett benutzte ein mit Stärke (Inulin) gefülltes Glasrohr und goss darauf einen in einem unpolaren Lösungsmittel (Ligroin) gelösten Chlorophyll-Pflanzenextrakt. Dann sorgte er für einen kontinuierlichen Fluss des Ligroins durch die Säule. Das Gemisch trennte sich in das grüne Chlorophyll a, das gelbe Chlorophyll b und das rot-braune Carotin.
Die Ionenchromatographie und die AtombombeAb 1942, Zweiter Weltkrieg Iowa und Tenessee, USA

Hightech-IonenchromatographieIm Jahr 2020Pädagogische Hochschule St. Gallen (PHSG)
Neugierig geworden? Dann viel Freude beim Analysieren der Getränkeinhaltsstoffe und der Reise durch die Ionenchromatographie!
Reise durch die IC
Injektion – Trennung – Detektion
Die Analyse lässt sich in drei Schritte unterteilen:
Injektion – Trennung – Detektion
Ergebnisse erscheinen in einem Chromatogramm.
Hinweis: In der rechten Navigationsleite gibt es einen Button mit dem ihr den Text ausblenden könnt.
Eluent (mobile Phase, Elutions-, Fliess-, Laufmittel)
Was das Blut in unserem Körper, ist der Eluent in der Ionenchromatographie. In Kapillarleitungen durchströmt der Eluent die Probe vom Injektor zur Säule bis zum Detektor. Mehr dazu erfahrt ihr in den folgenden Videos in diesem Kapitel.
Trennsäule (stationäre Phase)
Chromatographische
Trennsäule, in der die Trennung der Komponenten abläuft. Für Anionen benutzt man Anionen-, für Kationen Kationenaustauschersäulen. Wie man sich den Ionenaustausch vorzustellen hat, erfahrt ihr in einem der folgenden Videos in diesem Kapitel.
Leitfähigkeitsdetektor
Im Leitfähigkeitsdetektor werden die von der Trennsäule eluierenden Komponenten als Funktion der Zeit detektiert. Dazu mehr in einem der folgenden Videos in diesem Kapitel. Der Berzelius-IC arbeitet mit Leitfähigkeitsdetektion ohne Suppression. Was Suppression ist, dazu später mehr.
(Hochleistungs-)Pumpe
Die Hochleistungspumpe pumpt den Eluenten konstant und pulsationsfrei über die Kapillarleitungen durch den Ionenchromatographen.
Injektionsventil (Sechswegeventil)
Vom Injektor gelangt die Probe unter Normaldruck in die Probenschleife. Beim Umschalten wird genau dieses Probenschleifenvolumen in den Hochdruckbereich des Ionenchromatographen überführt.
Vorsäule
Schützt die Trennsäule vor Verunreinigungen aus Probe und Eluent. Besteht aus derselben Säulenfüllung wie die Trennsäule.
Entlüftungsventil
Für das manuelle Entfernen der Luft aus dem Ionenchromatographen.
Kupplungstück
Zum Verbinden der Kapillarleitungen, wenn keine Trennsäule angeschlossen ist.
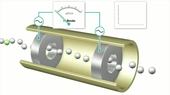
Der Weg der Probe durch den Ionenchromatographen
Dieses Video zeigt den Weg der Probe von der Injektion über die Trennung bis hin zum Detektor.
Reise durch den Ionenchromatographen
Der Anionenaustausch in der Säule
Dieses Video zeigt, wie der Anionenaustausch in der Säule modellhaft abläuft.
Reise durch die Trennsäule
Die Austauscherplätze in der SäuleDie funktionelle Gruppen
–SO₂(OH).
Anionenaustauscher besitzen dagegen basische funktionelle Gruppen und ihre Bindungskraft steigt in der Reihenfolge –NH₂, –NHR, –NR₂ und –NR₃⁺.
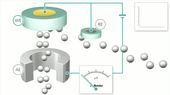
Der Weg der Probe durch den Leitfähigkeitsdetektor
Dieses Video zeigt die Funktionsweise des Detektors und erklärt wie ein Chromatogramm entsteht.
Reise durch den Leitfähigkeitsdetektor
Interview mit einem Entwickler
Interview mit Dr. Markus Laeubli
Interview mit einem der bekanntesten IC-Entwickler, in dem ihr viel Interessantes und Überraschendes zur IC und deren Anwendungen erfahrt.
Interview mit einem IC-EntwicklerDr. Markus Laeubli
-
Studium
Technikum Winterthur
(1974–1977)
- Studium und Promotion (1979–1985) an der ETH Zürich
- entwickelt und vertreibt seit über 35 Jahren Ionenchromatographen bei der Metrohm AG
- Zählt weltweit zu den "Gurus" der IC
STUDIUM: Theorie der IC
STUDIUMTheorie der IC
Eine ganze Menge Stoff, den ihr nun bitte im Selbststudium festigt, bevor es dann ans Aufbauen und Analysieren geht.
Hier sind die wichtigsten Zusammenhänge und Begriffe nochmals zusammengefasst.
PRAKTISCHES: Aufbau und Einrichten des ICs
PRAKTISCHESAufbau und Einrichten des Ionenchromatographen

- den IC auspacken, Transportsicherungen entfernen und den IC an den Computer anschliessen
- den Eluenten herstellen und
- den Eluenten, die Vorsäule und die Säule anschliessen sowie das IC-System spülen
ANALYSIEREN: Kationen und Amine in Getränkeproben
PRAKTISCHESAnalysieren der Getränke ...... auf Kationen und biogene Amine
Die Anleitung dazu gibt es hier.
Qualitätskontrolle
Schadstoffen in Getränken auf der SpurImmer stärkere Qualitätskontrollen
Die Ionenchromatographie in der ...... Getränke- und Lebensmittelanalytik

Je nach Element und Verbindung braucht man eine andere Säule und/oder einen anderen Detektor. Sehr oft ist das Problem die Matrix, also die Probenbeschaffenheit. Nicht jede Probe kann man direkt einspritzen wie die Tabelle im Hintergrund zeigt (Hinweis: Text in der Navigationsleiste ausblenden). Bier und Cola müssen z. B. verdünnt, Orangensaft muss zusätzlich noch filtriert werden. Gerade der Probenvorbereitung kommt, wie wir das bereits im Interview mit Dr. Markus Laeubli erfahren haben, eine sehr grosse Bedeutung zu.
Mehr dazu sowie zu Eluenten, Säulen und Detektoren sowie Trenn- und Detektionstechniken im folgenden Kapitel.
Probenvorbereitung, Eluenten, Säulen und Detektoren
Inline-Dialyse einer Milchprobe
Das Video zeigt, wie Ionen selektiv durch die halbdurchlässige Membran diffundieren und die Fettmoleküle zurückgehalten werden.
Fehleranfällige manuelleProbenvorbereitung
All das ist möglich, sogar vollautomatisch, wie z. B. im Fall der Milchanalytik: Milch ist eine Emulsion, enthält in Wasser gelöste Fetttröpfchen, die bei direkter Injektion die Trennsäule schädigen würden. Milch muss daher dialysiert, die zu bestimmenden Komponenten sozusagen herausgefiltert bzw. herausgewaschen werden. Dazu gibt es in der Dialysezelle zwei voneinander getrennte Seiten. Auf der einen Seite zirkuliert die Milchprobe, auf der anderen – der IC-Seite – die ultrareine Wasserprobe. Dazwischen eine halbdurchlässige Membran, die nur für die zu analysierenden Komponenten durchlässig ist. Störende Fette und Eiweisse bleiben so auf der Probenseite zurück. Treibende Kraft der Reaktion sind die Konzentrationsunterschiede auf beiden Seiten der Membran. Auch die Blutwäsche funktioniert nach diesem Prinzip.
Die mobile PhaseEluenten
Typische Inhaltstoffe der wässrigen Eluenten sind: Alkali-hydroxide, aromatische und aliphatische Carbonsäuren, Sulfonsäuren, anorganische Säuren wie Schwefel-, Salz- und Phosphorsäure sowie Puffer.
Die Auswahl der Eluenten ist u. a. vom Detektor abhängig. Eluenten mit hoher Leitfähigkeit erhöhen das Untergrundrauschen im Leitfähigkeitsdetektor genauso wie UV/VIS-aktive Substanzen wie z. B. aromatische Carbonsäuren die direkte UV/VIS-Detektion stören. Oxal- und Zitronensäure sind dagegen UV-transparent, weshalb sie sich für die direkte UV/VIS-Detektion eignen.
Über den Eluenten und dessen pH-Wert lässt sich die Elutionsreihenfolge beinflussen. Eine sehr wichtige Substanzklasse sind die aromatischen Carbonsäuren und ihre Salze, wie z. B. Benzoesäure, 4-Hydroxbenzoesäure, Salicylsäure und Phthalsäure. Diese Komponenten besitzen bei geringer Eigenleitfähigkeit eine sehr hohe Elutionskraft, weshalb sie für die direkte Leitfähigkeitsdetektion so beliebt sind. Bei mehrbasigen Säuren wird die Elutionskraft auch über den pH-Wert gesteuert. Beliebt in der Kationenanalytik ist Dipicolinsäure. Sie verkürzt Retentionszeiten durch Komplexbildung. Ist die Komplexbildung jedoch zu stark, dann werden z. B. die Erdalkalimetalle ladungstechnisch komplett neutralisiert und „laufen“ ungetrennt durch die Säule hindurch. Bei höheren Dipicolinsäurekonzentrationen kann auch die Elutionsreihenfolge wechseln, so dass Magnesium als letztes Kation nach Calcium eluiert.
Die mobile PhaseElutionsmodi
Die stationäre PhaseSäulen und Trennprinzipien
- Anionen und Kationen mit und ohne Suppression
- Organische Säuren
- Übergangsmetalle
- Kohlenhydrate
- Amine
- Aminosäuren
Trennprinzipien
Daneben gibt es aber noch die Ionenpaarbildung und den Ionenausschluss. Beide Mechanismen sind jeweils in einem Video kurz erklärt.
Eine grosse Auswahl von ...... Detektoren ...... garantieren Flexibilität und Empfindlichkeit

Ihr wichtigster Detektor, wie weiter oben gesehen, ist der Leitfähigkeitsdetektor. Der Berzelius-IC misst die direkte Leitfähigkeit, jedoch nur mit mässiger Empfindlichkeit. Deutlich geringere Nachweisgrenzen erzielt die Leitfähigkeitsdetektion, wenn ihr eine Suppression vorgeschaltet ist.
Fragen und Experimente
VerständnisAnregungen für den Unterricht, Maturathemen und Experimente

Impressum
Impressum
Berzelius-Laborjournal
Editor-in-Chief: Dr. Alfred Steinbach
Herausgeber: Prof. Dr. Nicolas Robin
Berzelius-Editorial-Team in alphabetischer Reihenfolge: Dr. Martin Novotny, Prof. Dr. Florian Rietz, Markus Roth, Harald Sprenger, Dr. Alfred Steinbach, Eva Steingruber
Kamera, Film und Schnitt: Raphaël Maussion, Jennifer Dürlewanger, Medienwerkstatt PHSG
Berzelius – Im Hightech-Labor der Naturwissenschaften ist ein gemeinsames Projekt des damaligen Instituts Fachdidaktik Naturwissenschaften (heute: Institut Mathematische, Naturwissenschaftliche und Technische Bildung) der PHSG und der Metrohm Stiftung.
Wasserhärte und Ionenaustausch
Erst einmal zur ...... Ungeniessbarkeit des Wassers von Marah
Am Ende dieses BLJs, bei den Anregungen für den Unterricht, findet ihr ein Kapitel, das die Bestimmung der Wasserhärte mit der IC beschreibt.
Nun zur Frage nach ...... dem göttlichen Wunder
Aufbauanleitung
Transportsicherung entfernen
- Wir entfernen diese fünf Schrauben mit dem mitgelieferten Innensechskantschlüssel (6 mm). Die Positionen der fünf Schrauben sind mit blauen Pfeilen auf der Geräterückseite gekennzeichnet.
Gerät mit Computer verbinden
- Wir verbinden den IC – siehe roter Punkt – über das mitgelieferte, auch mit einem roten Punkt markierten USB-Kabel mit dem Computer.
Fliessmittel sammeln
- Dafür ziehen wir die Leitung aus der Flasche "Verbrauchtes Fliessmittel" und verbinden sie mit dem Luer-Anschluss auf der Geräterückseite ("Verbrauchtes Fliessmittel).
Reflexion und Fragen
Bauteile des IonenchromatographenBenenne die Komponenten des Ionenchromatographen
2 ...
3 ...
4 ...
5 ...
ReinstwasserGerade steht kein Reinstwasser zur Verfügung. Kann ich zur Herstellung des Eluenten auch destilliertes Wasser nehmen?
DetektorZucker sind nicht direkt Ionen, lassen sich aber mit der IC gut bestimmen. Wie und Warum? Und welcher Detektor ist erforderlich?
Elutionsreihenfolge 1 Wir bleiben bei unserem Salpetersäure/Aceton-Eluenten. Warum eluiert von den Kationen Natrium zuerst, warum Calcium zuletzt? Habt ihr eine Erklärung?
Elutionsreihenfolge 2Die Salpetersäurekonzentration im Eluenten ist nun 1 mol/L, und statt Aceton enthält der Eluent 0.7 mmol/L Dipicolinsäure. Wie sieht die Elutionsreihenfolge aus?
RechercheaufgabeKationen sollen in Milch bestimmt werden. Plane den Ablauf der Analyse von der Probenvorbereitung über die Auswahl der Säule bis hin zum Detektor.
RechercheaufgabeKohlenhydrate in löslichem Kaffee nachweisen – Was sagen internationale Richtlinien dazu?
Internationale Richtlinien wie ISO, DIN oder AOAC empfehlen die Ionenchromatographie. Findet ihr heraus, welche Zucker in diesen Normen bestimmt werden?
Berechnen und Messen der ...... Wasserhärte eures Leitungswassers
24.3 mg/L Magnesium entsprechen 10°fH
40.08 mg/L Calcium entsprechen 10°fH
Der Härtegrad wird aus der Summe der beiden berechnet.
Bestimmt den Härtegrad eures Leitungswassers und vergleicht den erhaltenen Wert mit den Angaben eures Wasserwerks.
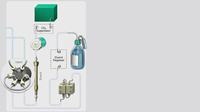
Aufbau, Eluent ansetzen sowie IC betriebsbereit machen
Herstellen des ...... EluentenWICHTIG!
- Wir arbeiten im Abzug, falls vorhanden.
- Wir tragen Schutzbrille und Labormantel.
- Für das Herstellen des Eluenten verwenden wir Reinstwasser und Chemikalien von hohem Reinheitsgrad.
- Die Eluentenflasche mehrmals mit Reinstwasser vor-spülen. Einen 2-L-Messkolben mit ca. 1 L füllen.
- 10 mL Salpetersäure (c = 1 mol/L) und 200 mL Aceton in den 2-L-Messkolben geben, mit Reinstwasser auffüllen und rühren.
- Eluent in die Eluentenflasche überführen.
Eluent anschliessen & IC einrichten
Eluent herstellen und IC einrichten
Das Video zeigt das Ansetzen des Eluenten und das Inbetriebnehmen des ICs.
Eluent herstellen und IC einrichtenDas Video zeigt ...
... das Anschliessen und Spülen von Vorsäule und Säule sowie
... das Konditionieren des Ionenchromatographen
Wenn all das erledigt ist, ist der Ionenchromatograph bereit für die Messung.
Kernspaltung
Seltene Erden
Weihnachten im Labor
Berzelius, sein Schüler Mosander und die Entdeckung des Versteckten: des Lanthans
J.J. Berzelius, G. Mosander und die Seltenen Erden November 1839Schweden
Mehr dazu weiter unten im Audio.
Heute ist der Begriff Ceriterde, der auf das erste Element dieser Reihe zurückgeht, eine Sammelbezeichnung für die Oxide der chemischen Elemente aus der Reihe der Seltenen Erden.
Lanthanoidenkontraktion
Die aussergewöhnlichen Eigenschaften der Lanthanoide machen sie zu etwas Besonderem. Ohne sie gäbe es weder Akkus noch LED-Lampen, keine Flachbildschirme und keine Smartphones. Mehr zu ihrer Verwendung in der Elektronik auf der Webseite der Uni Bayreuth, Didaktik Chemie.
Ionenpaarbildung
Mechanismus der Ionenpaarbildung
Das Video zeigt die Bindung der Analyten über das Tensid an die schwach polare Oberfläche der stationären Phase.
Ionenpaarbildung
Dem Eluenten wird ein sogenanntes Ionenpaarreagenz zugegeben, das aus Tensiden besteht. Die Ionenpaarreagenzien bilden mit Analytionen entgegengesetzter Ladung ungeladene Ionenpaare, die an der stationären Phase durch hydrophobe Wechselwirkungen retardiert werden.
Aufgrund der Bildungskonstanten der Ionenpaare und ihrer unterschiedlich starken Adsorption ist eine Trennung der Komponenten möglich.
Die Ionenpaarchromatographie trennt die gleichen Komponenten wie die Ionenaustauschchromatographie.
Ionenauschluss
Mechanismus der Ionenauschlusschromatographie
Die an den Kationenaustauscherharzen ablaufenden Trennungen basieren auf den Phänomenen: Donnan-Ausschluss, sterischer Ausschluss und Absorption.
Die Ionenausschluss-chromatographie ...
Die Säulen bestehen meist aus vollständig sulfonierten Kationenaustauschern, dessen Sulfonsäuregruppen Protonen tragen. Die funktionellen Gruppen sind hydratisiert und die Hydrathülle dient als negativ geladene Membran (Donnan), die nur für ungeladene, nicht dissoziierte Moleküle passierbar ist. Organische Carbonsäuren liegen in stark sauren Eluenten nahezu vollständig undissoziiert vor. Sie können die Donnan-Membran durchqueren und an der stationären Phase adsorbiert werden. Mehr dazu im Video.
Suppression,
Dreikammer-Suppressor der Metrohm AG
Das Video zeigt die drei Prozesse: Suppression, Regenerieren, Spülen
Leitfähigkeitsdetektion nach Suppression
Erst einmal zur Senkung der Untergrundleitfähigkeit: Nehmen wir als Beispiel den Eluenten Natriumhydrogencarbonat. Das Natriumkation wird auf dem stark sauren Kationenaus-tauscher gegen ein Wasserstoffion ausgetauscht und es entsteht schwach dissoziierte Kohlensäure (CO₂ + H₂O), die fast nicht elektrisch leitet. Das entstehende CO₂ wird im CO₂-Suppressor entfernt.
Dann zur Erhöhung der Analytleitfähigkeit: Wieder wird das Natriumkation, also das Gegenion des Chlorids, im Suppressor gegen das Wasserstoffion ausgetauscht. Das durchschnittlich leitende NaCl wird zur stark dissozierten Salzsäure HCL, die die Analytleitfähigkeit deutlich erhöht. Mehr dazu im Video.
Interview mit Dr. Markus Laeubli
zur Detektion nach Suppression
Was Dr. Markus Laeubli im Interview zur ... ... Detektion nach Suppression sagt
UV/VIS-Detektion
Mechanismus der UV/VIS-Detektion
Das Video zeigt eine Durchflusszelle in der die Probenkomponenten die UV/VIS-Strahlung absorbieren.
UV/VIS-Detektion
Die UV/VIS-Detektion ist die häufigste Detektionsmethode in der HPLC. Unterschieden werden Festwellenlängengeräte (Photometer) und Geräte mit variablen Wellenlängeneinstellungen (Spektrometer).
Amperometrische Detektion
Mechanismus der amperometrischen Detektion
Elektroaktive Komponeten werden zwischen Arbeits- (WE: working electrode) und Referenzelektrode (RE: reference electrode) oxidiert bzw. reduziert, wobei ein Strom zur Hilfselektrode (AE: auxiliary electrode) fliesst.
Amperometrische Detektion
Zwischen der Arbeits- und Referenzelektrode wird eine bestimmte Spannung angelegt. Passiert eine elektroaktive Komponente den Detektor, so wird diese bei ausreichend hohem Redoxpotential oxidiert bzw. reduziert und es fliesst ein Strom zur Hilfselektrode. Die Amperometrie ist eine sehr empfindliche Detektionsmethode.

















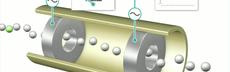


























































 IONENCHROMATOGRAPHIE
IONENCHROMATOGRAPHIE
 Vorwort
Vorwort
 Inhaltsverzeichnis
Inhaltsverzeichnis
 Ca. 1280 vor Christus
Ca. 1280 vor Christus
 März 1903
März 1903
 Tswetts Experiment
Tswetts Experiment
 Die Geburtsstunde der Chromatographie
Die Geburtsstunde der Chromatographie
 Ab 1942, Zweiter Weltkrieg
Ab 1942, Zweiter Weltkrieg
 Die schiere Unmöglichkeit der Lanthanoiden-Trennung
Die schiere Unmöglichkeit der Lanthanoiden-Trennung
 Injektion – Trennung – Detektion
Injektion – Trennung – Detektion
 Reise durch den Ionenchromatographen
Reise durch den Ionenchromatographen
 Reise durch die Trennsäule
Reise durch die Trennsäule
 Die funktionelle Gruppen
Die funktionelle Gruppen
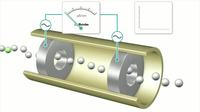 Reise durch den Leitfähigkeitsdetektor
Reise durch den Leitfähigkeitsdetektor
 Interview mit einem IC-Entwickler
Interview mit einem IC-Entwickler
 Aufbau und Einrichten des Ionenchromatographen
Aufbau und Einrichten des Ionenchromatographen
 Analysieren der Getränke ...
Analysieren der Getränke ...
 Immer stärkere Qualitätskontrollen
Immer stärkere Qualitätskontrollen
 ... Getränke- und Lebensmittelanalytik
... Getränke- und Lebensmittelanalytik
 Probenvorbereitung
Probenvorbereitung
 Eluenten
Eluenten
 Elutionsmodi
Elutionsmodi
 ... Detektoren ...
... Detektoren ...
 Anregungen für den Unterricht, Maturathemen und Experimente
Anregungen für den Unterricht, Maturathemen und Experimente
 Impressum
Impressum
 ... Ungeniessbarkeit des Wassers von Marah
... Ungeniessbarkeit des Wassers von Marah
 ... dem göttlichen Wunder
... dem göttlichen Wunder
 ... Ionenaustauscher
... Ionenaustauscher
 Transportsicherung entfernen
Transportsicherung entfernen
 Gerät mit Computer verbinden
Gerät mit Computer verbinden
 Fliessmittel sammeln
Fliessmittel sammeln
 Benenne die Komponenten des Ionenchromatographen
Benenne die Komponenten des Ionenchromatographen
 Gerade steht kein Reinstwasser zur Verfügung. Kann ich zur Herstellung des Eluenten auch destilliertes Wasser nehmen?
Gerade steht kein Reinstwasser zur Verfügung. Kann ich zur Herstellung des Eluenten auch destilliertes Wasser nehmen?
 Zucker sind nicht direkt Ionen, lassen sich aber mit der IC gut bestimmen. Wie und Warum? Und welcher Detektor ist erforderlich?
Zucker sind nicht direkt Ionen, lassen sich aber mit der IC gut bestimmen. Wie und Warum? Und welcher Detektor ist erforderlich?
 Kationen sollen in Milch bestimmt werden. Plane den Ablauf der Analyse von der Probenvorbereitung über die Auswahl der Säule bis hin zum Detektor.
Kationen sollen in Milch bestimmt werden. Plane den Ablauf der Analyse von der Probenvorbereitung über die Auswahl der Säule bis hin zum Detektor.
 Kohlenhydrate in löslichem Kaffee nachweisen – Was sagen internationale Richtlinien dazu?
Kohlenhydrate in löslichem Kaffee nachweisen – Was sagen internationale Richtlinien dazu?
 ... Wasserhärte eures Leitungswassers
... Wasserhärte eures Leitungswassers
 ... Eluenten
... Eluenten
 Eluent herstellen und IC einrichten
Eluent herstellen und IC einrichten
 Kernspaltung
Kernspaltung
 November 1839
November 1839
 Die faszinierenden Lanthanoide
Die faszinierenden Lanthanoide
 Lanthanoidenkontraktion
Lanthanoidenkontraktion
 Ionenpaarbildung
Ionenpaarbildung
 Die Ionenausschluss-chromatographie ...
Die Ionenausschluss-chromatographie ...
 Leitfähigkeitsdetektion nach Suppression
Leitfähigkeitsdetektion nach Suppression
 ... Detektion nach Suppression sagt
... Detektion nach Suppression sagt
 UV/VIS-Detektion
UV/VIS-Detektion
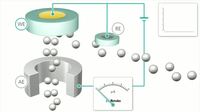 Amperometrische Detektion
Amperometrische Detektion