Titelseite, Vorwort, Inhaltsverzeichnis
ISSN: 2571-5860VERDAUUNG DER PANTOFFELTIERCHEN – neue Farbe für den DurchblickMultimediale Berzelius-Maturaarbeit, 1.02, 08/2024 (V01: 12/2023)
betreut von Dieter Burkhard,
angefertigt an der Kantonsschule Heerbrugg (2021)
mit multimedialem Tuning von Dr. Martin Novotny
Hier das Original: KONKURRENZ FÜR KONGOROT – gefahrloser Direktfarbstoff zur Fütterung von Pantoffeltierchen
Wissenschaftliche Publikationen:
-
Benedikt Schöbi (2024):
Konkurrenz für Kongorot. Gefahrloser pH-Indikator für die Fütterung von Pantoffeltierchen. chemie + biologie, Heft 1 / 2024, S. 28-31. Link: VSN: c+b-Heft
- Benedikt Schöbi (2024): Eine gefahrlose Färbemethode zum Sichtbarmachen der Verdauungsvorgänge beim Pantoffeltierchen im Schulunterricht. NGH-Jugendpreis 2022. Naturhistorica, Band 166, Seiten 155-180. Links: SGBN-Eintrag, NGH: Naturhistorica
- Jugendpreis Naturhistorische Gesellschaft Hannover 2022
- 2. Preis NWG-Preis für herausragende Maturaarbeiten in den naturwissenschaftlichen Fächern 2022
- Anerkennungspreis Heerbrugg Kantonsschulpreis 2022
Vorwort
An diesen Einzellern kannst du hervorragend die Nahrungsaufnahme, Verdauung und Ausscheidung primitiver Lebensformen unter dem Mikroskop erforschen. Am besten gelingt das, wenn wir die Nahrung, etwa Bäckerhefe, mit einem pH-Indikator einfärben. Der Farbumschlag bei verändertem pH-Wert gibt uns einen tieferen Einblick in den Verdauungsprozess.
Leider ist der dafür gebräuchliche pH-Indikator Kongorot krebserregend und damit nicht für Schulen geeignet. Die vorliegende Maturaarbeit hat zum Ziel, ungiftige Ersatzstoffe zu finden, die im Unterricht gleichwertige Ergebnisse liefern wie Kongorot.
Die Untersuchungen führte ich mit zwei Durchlichtmikroskopen durch: mit einem Leica DM E der Kantonsschule Heerbrugg (mit Adapter für Spiegelreflexkamera und Smartphone) und einem Zeiss-Axiolab-5 -Mikroskop aus dem Gerätepark des Berzelius-Projekts der Pädagogischen Hochschule St. Gallen (PHSG). Das Axiolab 5 erlaubte es mir, auch bei starken Vergrösserungen Bilder mit kurzen Belichtungszeiten zu schiessen. Dies ist notwendig, um die sehr feinen und sich schnell bewegenden Cilien («Wimpern») scharf abzulichten. Neugierig geworden? Dann komm doch mit auf meine Forscherreise durch den Mikrokosmos dieser faszinierenden Kleinstlebewesen.
Inhaltsverzeichnis

HAUPTKAPITEL ⇓ & EXKURSE ⇒
Fressvorgang & Cilienbewegung der Pantoffeltierchen
Mikrokosmos in der Flasche
Welche Ausrüstung ich benutzt und wie ich die mikroskopischen Aufnahmen meiner Maturaarbeit gemacht habe, erfährst du hier.
Dann noch etwas. Die Pantoffeltierchen sind für unsere Wahrnehmung enorm schnell unterwegs. Ich habe ein paar Tricks benutzt, um sie ruhig zu stellen. Wie das gelungen ist erfährst du hier.
Um das Video abzuspielen, muss der Play-Knopf unten links gedrückt werden.
Blick durchs Leica-DME-MikroskopStändige Strömung
Pantoffeltierchen erzeugen mit ihren Wimpern, den Cilien, eine ständige Wasserströmung. Damit transportieren sie die Nahrung – sie strudeln diese über Mundfeld und Zellschlund in sich hinein. Im Video fällt zuerst einmal auf, wie die kleinen runden Hefezellen durch die Cilienbewegung des Pantoffeltierchens herum schwirren. Damit du es besser siehst, habe ich die Geschwindigkeit des Videos etwas heruntergesetzt.
Blick durchs Zeiss-Axiolab-5-MikroskopCilienbewegung
Cilienschlag
Pantoffeltierchen (Paramecium) frisst Hefe
Das geht für uns Laien in einem normalen Video zu schnell. Nachfolgend illustriere ich den Fressvorgang mit Hilfe von Skizzen und Mikroskopaufnahmen.
Wenn dich dieser Text vor dem Video stört, dann gehe rechts oben aufs Menü und blende ihn aus.
Als SkizzeEinstrudeln
Mithilfe der Wimpernbewegung lässt das Pantoffeltierchen Nahrungspartikel in sein trichterförmigens Mundfeld strömen (1). Am Ende dieser breiten Vertiefung, dem Zellmund, sammeln sich die Hefezellen.
Als SkizzeAbschnürung des Nahrungsvesikels
Diese Aufnahme von Substanzen aus dem Extrazellularraum in die Zelle wird allgemein als Endozytose bezeichnet und heisst bei fester Nahrung Phagocytose.
Durchs MikroskopEinstrudeln
Durchs MikroskopAbschnürung des Nahrungsvesikels –Teil 1
Durchs MikroskopAbschnürung des Nahrungsvesikels –Teil 2
Durchs MikroskopAbschnürung des Nahrungsvesikels –Teil 3
Durchs MikroskopAbschnürung des Nahrungsvesikels –Teil 4
Auf seinem Weg durch die Zelle fusioniert das Nahrungsvesikel bald mit weiteren Vesikeln zu einer Nahrungsvakuole. Vakuolen entstehen also durch Verschmelzung mehrerer Vesikel.
Fütterungsversuch mit Kongorot
Wir verlassen das S/W-Zeitalter ...... und beginnen einzufärbenFütterungsversuch mit pH-Indikator Kongorot
Kongorot-Hefe im "Bauch" des Pantoffeltierchens
Der pH-Wert muss im Verlauf der Cyclose gesunken sein, weil sich das Kongorot in den Hefezellen in den Nahrungsvakuolen blau verfärbt. Diese Ansäuerung dient vermutlich dazu, phagozytierte Lebewesen wie Bakterien zu töten.
Die Cyclose des Pantoffeltierchensvom Zellschlund bis zum Zellafter
Ergebnisse der Maturaarbeit
Nun zum Kern meiner Maturaarbeit
In der hier vorgestellten Maturaarbeit wurde deswegen nach einem ungefährlichen Ersatz für Kongorot gesucht, also nach ungefährlichen pH-Indikatoren, die im selben pH-Bereich gut sichtbar farblich umschlagen. Das ist mir gelungen! Kongorot kann durch Bromphenolblau ersetzt werden, und vermutlich eignet sich auch Bromkresolgrün. Aber sieh' dir das selbst an, auf den folgenden Seiten.
Bromphenolblau
Im Hintergrund siehst du Hefezellen, die ich mit Bromphenolblau färbte. Das Foto habe ich mit dem Mikroskop Zeiss Axiolab 5 und der Kamera Zeiss Axiocam 208 des Berzelius-Projekts bei 400-facher Vergrösserung geschossen.
* Anderer Name: 3,3′,5,5′-Tetrabrom-phenolsulfonphthalein
Bromkresolgrün
Im Hintergrund siehst du Hefezellen, die ich mit Bromkresolgrün färbte. Das Foto habe ich mit dem Equipment des Berzelius-Projekts (Zeiss Axiolab 5 und Zeiss Axiocam 208) bei 400-facher Vergrösserung gemacht.
* Andere Namen: Bromkresolblau und 3,3′,5,5′-Tetrabrom-m-kresolsulfon-phthalein
Vergleich der pH-Indikatoren
Ich gab die gefärbten Hefen in Phosphatpufferlösungen nach Sørensen, die auf pH-Werte von 7 bzw. 2 eingestellt waren. Diese Aufnahmen dienten mir als Farbreferenzen, um farblich umgeschlagene Hefen in Nahrungsvakuolen zweifelsfrei als solche zu identifizieren.
Alle Fotos habe ich aufgenommen mit dem Equipment des Berzelius-Projekts (Zeiss Axiolab 5 und Zeiss Axiocam 208 ) bei 400- oder 630-facher Vergrösserungt.
Wenn ihr das Hintergrundbild ohne den darüber liegenden Text betrachten wollt, müsst ihr das Menü rechts oben öffnen und «Text ausblenden» wählen.
Ergebnis mit Bromphenolblau
Das Hintergrundbild zeigt ein in 3%iger Gelatinelösung ruhiggestelltes Pantoffeltierchen, das mit Bromphenolblauhefe gefüttert wurde. Nach rund 30 Minuten enstehen Nahrungsvakuolen mit farblich umgeschlagener gelber Hefe.
Ergebnis mit Bromkresolgrün
Schüleraufnahmen
Im Praxistest: Kongorot
Im Hintergrund die Aufnahme einer Schülerin mit Kongorot. Die Ruhigstellung erfolgte mit Watte, und das Foto wurde mit dem eigenen Smartphone (iPhone 8) und dem Leica DM E mit 400-facher Vergrösserung gemacht. Der Umschlag des pH-Indikators ist gut zu erkennen.
Bromphenolblau im Praxistest
Fazit
FazitKongorot versus Bromphenolblau
Damit diese mikroskopischen Beobachtungen funktionieren, müssen die Pantoffeltierchen zuerst ohne Ruhigstellung 15 bis 30 Minuten lang die mit Kongorot eingefärbte Hefe fressen. Bei Bromphenolblau ist die notwendige Fresszeit aus noch ungeklärten Gründen tendenziell länger. Erste gelbe Vesikel entstehen erst nach mehr als 30 Minuten.
Ausserdem fand ich einen weiteren potentiell geeigneten pH-Indikator, nämlich Bromkresolgrün. Diesen habe ich aus Zeitgründen noch nicht umfassend geprüft. Erste vielversprechende Tests zeigten eine vergleichsweise kürzere Fresszeit bis zum ersten beobachtbaren Farbumschlag im Pantoffeltierchen. In wissenschaftlichen Studien wurde diese Alternativen bereits eingesetzt (vgl. The Correlation of Digestive Vacuole pH and Size with the Digestive Cycle in Paramecium caudatum von Agnes Fok et al. 1982).
Zurück zum Bromphenolblau und einem weiteren Vorteil der...... geringeren Verwechslungsgefahr
Die Unterscheidung gelingt gut mit einem Differentialinterferenzkontrastmikroskop (DIC-Mikroskop). Wie im rechten Bild zu sehen, erscheinen darunter die Kristalle leuchtend gelb. Diese Apparatur ist allerdings teuer und steht Mittelschulen gewöhnlich nicht zur Verfügung. Das rechte Bild durfte ich in der limnologischen Station der Universität Zürich machen.
Bei der Verwendung von «Bromphenolblauhefe» kommt es zu keiner Verwechslung mit anderen Zellstrukturen. Die Farben der Nahrungsvakuolen erscheinen unter dem Durchlichtmikroskop immer deutlich hellblau oder gelb.
Warum sich diese Farben einstellen, kann sogar auf molekularer Ebene berechnet werden und eignet sich ideal für einen weiterführenden Unterricht. Mehr dazu hier.
Quellen & Impressum
Berzelius-MaturaarbeitImpressum
Originalarbeit: KONKURRENZ FÜR KONGOROT – gefahrloser Direktfarbstoff zur Fütterung von Pantoffeltierchen, Benedikt Schöbi unter der Betreuung von Dieter Burkhard, Kantonsschule Heerbrugg, SJ 2021–2022
Zeichnungen zur Endocytose und Cyclose: Magdalena Schöbi
Editor-in-Chief und Projektleiter: Dr. Alfred Steinbach
Berzelius-Editorial-Team in alphabetischer Reihenfolge:
Dr. Adrian Brugger, Dr. Claudia Buser Moser, Marianne Leuenberger, Dr. Martin Novotny, Dr. Alfred Steinbach, Dominik Tschirky, Patrick Massen (Medienwerkstatt.PHSG).
Mikroskop-Technik
Lichtmikroskopie
MIKROSKOPIE – oder der bewaffnete Blick.
Durchlichtmikroskop Leica DM E
Adapter für die Spiegelreflexkamera
Die gesamte Einheit zeichnet sich durch ihre rasche Nachführung und die Farbtreue der Aufnahmen aus, was sehr wichtig ist für das Fotografieren der sich schnell bewegenden Pantoffeltierchen.
Adapter für das Smartphone
Durchlichtmikroskop Zeiss Axiolab 5
Der Revolver dieses Mikroskopes ist mit Objektiven für eine 40-, 100-, 400-, 630- und 1000-fache Gesamtvergrösserung bestückt. Ohne Immersionsöl gelangen mir scharfe Aufnahmen bis zu einer 630-fachen Vergrösserung (siehe nächsten Nebenerzählstrang zur Ruhigstellung der Pantoffeltierchen)
Ein weiterer Vorteil dieses Mikroskopes ist die zugehörige Software. Mit der App Zeiss ZEN Core konnte ich die Fotos direkt bearbeiten (Weissabgleich etc.) und den Massstabsbalken automatisch einblenden.
Bildbearbeitung
Ich verbesserte ausschliesslich Belichtung, Kontrast und Weissabgleich. Mit Affiunity Photo konnte ich Bilder in allen gängigen Formaten lesen und und ausgeben.
Die Videoaufnahmen speicherte ich ohne weitere Bearbeitung als MP4-Format.
Ruhigstellungen der Paramecien
Ruhigstellen der Pantoffeltierchen
- Watte
- Methylcelluloselösung
-
Gelatinelösung
Erste Methode Watte
Zweite Methode Methylcelluloselösung
Dritte Methode Gelatinelösung
Die Farben von BromphenolblauBetrachtung auf molekularer Ebene
Diese Thematik ist für vertiefende Kurse (Schwerpunkt- und Ergänzungsfach bzw. Leistungskurse) für den Unterricht gut geeignet.
Woodward-Fieser-Regel zum Berechnen der Wellenlänge des absorbierten Lichts:Deprotonierte Formvon Bromphenolblau
- Grundsystem homoannular = 253 nm
- 10 weitere Doppelbindungen = 300 nm
- 1 S-R-Bindung = 30 nm
- 4 Br-Atome = 20 nm
Gemäss Messung von Deitert aus 2009: 590 bis 595 nm
Du könntest das selber nachmessen, z. B. mit dem Absorbtionsphotometer des Berzelius-Projekts der PHSG. Das Berzelius-Laborjournal (BLJ) PHOTOSPEKTROMETRIE – subjektiver Anschein versus objektive Messmethode gibt dir zusätzlich einen Überblick über den Hightech-Gerätepark mit den ausleihbaren Geräten
Woodward-Fieser-Regel zum Berechnen der Wellenlänge des absorbierten LichtsProtonierte Formvon Bromphenolblau
- Grundsystem homoannular: 253 nm
- 3 weitere Doppelbindungen: 90 nm
- 1 S-R-Gruppe: 60 nm
Gemäss Messung von Deitert aus 2009: 430 bis 440 nm
*Die anderen zwei aromatischen π-Systeme sind zwar über das Methankohlenstoffatom miteinander verbunden, aber π-elektronisch voneinander getrennt (da sp3-hybridisiert). Die beiden Aromaten absorbieren daher Licht im UV-Bereich (bei 303 nm), was keinen Einfluss auf das sichtbare Licht hat, da durchsichtig. Hier die Berechnung für die zwei Ringe:
- Grundsystem homoannular: 253 nm
- 1 Doppelbindung: 30 nm
- 2 Br-Substituenten: 20 nm





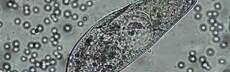

























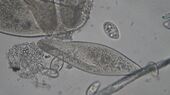
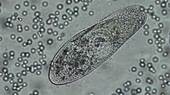

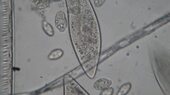

































 VERDAUUNG DER PANTOFFELTIERCHEN – neue Farbe für den Durchblick
VERDAUUNG DER PANTOFFELTIERCHEN – neue Farbe für den Durchblick
 Vorwort
Vorwort
 Mikrokosmos in der Flasche
Mikrokosmos in der Flasche
 Ständige Strömung
Ständige Strömung
 Cilienbewegung
Cilienbewegung
 Cilienschlag
Cilienschlag
 Pantoffeltierchen (Paramecium) frisst Hefe
Pantoffeltierchen (Paramecium) frisst Hefe
 Einstrudeln
Einstrudeln
 Abschnürung des Nahrungsvesikels
Abschnürung des Nahrungsvesikels
 Einstrudeln
Einstrudeln
 Abschnürung des Nahrungsvesikels –Teil 1
Abschnürung des Nahrungsvesikels –Teil 1
 Abschnürung des Nahrungsvesikels –Teil 2
Abschnürung des Nahrungsvesikels –Teil 2
 Abschnürung des Nahrungsvesikels –Teil 3
Abschnürung des Nahrungsvesikels –Teil 3
 Abschnürung des Nahrungsvesikels –Teil 4
Abschnürung des Nahrungsvesikels –Teil 4
 ... und beginnen einzufärben
... und beginnen einzufärben
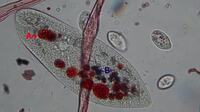 Kongorot-Hefe im "Bauch" des Pantoffeltierchens
Kongorot-Hefe im "Bauch" des Pantoffeltierchens
 Die Cyclose des Pantoffeltierchens
Die Cyclose des Pantoffeltierchens
 Nun zum Kern meiner Maturaarbeit
Nun zum Kern meiner Maturaarbeit
 Bromphenolblau
Bromphenolblau
 Bromkresolgrün
Bromkresolgrün
 Vergleich der pH-Indikatoren
Vergleich der pH-Indikatoren
 Ergebnis mit Bromkresolgrün
Ergebnis mit Bromkresolgrün
 Im Praxistest: Kongorot
Im Praxistest: Kongorot
 Bromphenolblau im Praxistest
Bromphenolblau im Praxistest
 Fazit
Fazit
 ... geringeren Verwechslungsgefahr
... geringeren Verwechslungsgefahr
 Impressum
Impressum
 Lichtmikroskopie
Lichtmikroskopie
 Durchlichtmikroskop Leica DM E
Durchlichtmikroskop Leica DM E
 Adapter für die Spiegelreflexkamera
Adapter für die Spiegelreflexkamera
 Adapter für das Smartphone
Adapter für das Smartphone
 Durchlichtmikroskop Zeiss Axiolab 5
Durchlichtmikroskop Zeiss Axiolab 5
 Bildbearbeitung
Bildbearbeitung
 Ruhigstellen der Pantoffeltierchen
Ruhigstellen der Pantoffeltierchen
 Watte
Watte
 Methylcelluloselösung
Methylcelluloselösung
 Gelatinelösung
Gelatinelösung
 Die Farben von Bromphenolblau
Die Farben von Bromphenolblau
 Deprotonierte Form
Deprotonierte Form
 Protonierte Form
Protonierte Form